As mudanças
de estado:
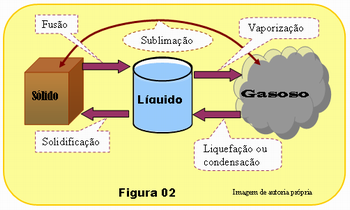
Quando o sólido é aquecido ele
passa pelo processo de fusão e se torna um líquido. Quando esse material em um
novo estado (líquido) é aquecido novamente ele evapora, se tornando agora um
vapor ou gás.
Esse material pode também ser
resfriado do gás para o líquido, esse processo se chama liquefação ou
condensação. Quando esse líquido é resfriado mais ainda, ele passa pelo
processo de solidificação, tornando-se assim um sólido.
Há também um processo chamado de
sublimação que é quando o material passa diretamente do estado sólido para o
gás, esse processo pode ser também ao contrário, passando do gás para o sólido.
Como é mostrado no gráfico abaixo,
no aquecimento da água, por exemplo, é o início da fusão à 0ºC, só existindo
água sólida. Na fusão, coexistem sólido e líquido e a temperatura permanece
constante(0ºC).No fim da fusão, existe somente água líquida a 0ºC e a temperatura está sendo
aumentada. Quando atinge 100ºC, começa a ebulição, coexistem líquido e vapor em
temperatura constante(100ºC). No fim da ebulição, só existe vapor de água e a
temperatura está sendo aumentada. No aquecimento, ocorre o inverso deste
processo.

Quando um gráfico apresenta os
dois patamares, representa uma substância e quando não apresenta patamares,
representa uma mistura. Mas há duas exceções:
Mistura eutética: quando a mistura apresenta o patamar de
fusão definido constante.
Mistura azeotrópica: quando apresenta o patamar de ebulição constante.
Fontes:
Apostila de química 1ª Série do Ensino Médio, Cláudia Cinara
e Luciane Soares.
Assista:
Escrito por:
Bruno Morais Nº 14
Bernardo Sette Nº 12
Gabriel Lopes Nº
17
José Neto
Nº 22
Matheus Guerra Nº 36
Nenhum comentário:
Postar um comentário